
引言
國產崛起,填補空白 1月兩款ECMO獲批, 危重患者的“終極武器” 從研發到臨床 ——多維度還原救命神器 期待國產技術迎來更多高光時刻引言
“2023年1月,國家藥監局應急批準漢諾醫療(1.4日)和長征醫療(1.17日)的ECMO產品(體外肺/心肺支持輔助設備)上市,系國內首款和第二款獲批的國產ECMO設備,填補了國內空白。”
體外膜肺氧合
Extracorporeal Membrane Oxygenation,ECMO
又稱“人工肺、葉克膜”,一種重要的體外生命支持技術,將患者的部分靜脈血從體內引到體外,經膜肺氧合后再由驅動泵將血液回輸體內,對嚴重循環、呼吸衰竭的病人進行有效支持,主要用于心臟功能不全、呼吸功能不全的支持,被譽為ICU里把守“生死之門”的最后一道防線,搶救新冠肺炎危重病人的“終極武器”,ECMO作為常規治療無效的危重型新冠肺炎患者的挽救性治療設備,是《新型冠狀病毒肺炎診療方案》中明確的治療措施,但受制于研發難、生產難、技術門檻高、臨床使用制約等多因素限制,國產企業無ECMO設備獲批上市,我國ECMO嚴重依賴進口,主要被美敦力(Medtronic)、理諾琺(LivaNova)和邁維柯(Maquet)三家壟斷。
ECMO的臨床落地
 離心泵和膜肺是ECMO的兩大核心構件,分別起到人工心臟和人工肺的作用,是最具技術研發難度的部分,也是當前ECMO國產化的難點。而臨床試驗的難點在于試驗方案設計面臨無從參考的困難,國內尚無ECMO審批的技術指導原則,且此前沒有獲批的產品,故沒有臨床試驗的經驗可供借鑒。目前公開數據查詢到的臨床試驗方案設計有“前瞻性、多中心、隨機、單盲、陽性平行對照”及“前瞻性、多中心、單組目標值”兩種,試驗一般在醫院的重癥監護室(ICU)入組受試者,根據在阜外醫院開展的一項臨床試驗方案顯示,方案要求入組28例患者,存活率達50%以上。
離心泵和膜肺是ECMO的兩大核心構件,分別起到人工心臟和人工肺的作用,是最具技術研發難度的部分,也是當前ECMO國產化的難點。而臨床試驗的難點在于試驗方案設計面臨無從參考的困難,國內尚無ECMO審批的技術指導原則,且此前沒有獲批的產品,故沒有臨床試驗的經驗可供借鑒。目前公開數據查詢到的臨床試驗方案設計有“前瞻性、多中心、隨機、單盲、陽性平行對照”及“前瞻性、多中心、單組目標值”兩種,試驗一般在醫院的重癥監護室(ICU)入組受試者,根據在阜外醫院開展的一項臨床試驗方案顯示,方案要求入組28例患者,存活率達50%以上。
國內ECMO產品研發進度

國內研發企業少,產品大多在臨床試驗進程中
數據來源:公開資料
主要研發企業
 何為應急審批?
何為應急審批?
兩款ECMO均為應急批準,應急審批是指當社會存在突發公共衛生事件威脅以及突發公共衛生事件發生時,為有效預防、及時控制和消除突發公共衛生事件危害,確保應急所需醫療器械能夠盡快完成注冊審批的程序。在產品注冊申報過程中,國家藥監局按照“統一指揮、早期介入、快速高效、科學審批”的原則,成立應急審評工作組,專人負責、全程指導、發布技術審查指導原則,加大產品注冊申報指導,加快審評審批進程,在保證安全、有效的基礎上推動產品盡快上市。截至2022年12月22日CMDE統計,自2020年1月以來,已有170個產品經應急審批上市。

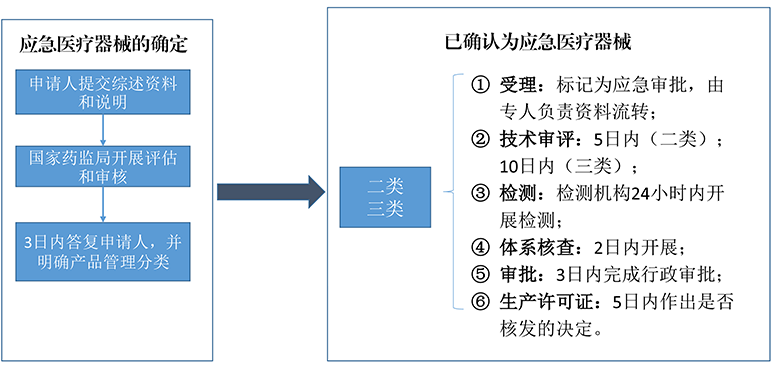
應急審批流程(圖源:CMDE)
專家共識&指導原則
為提高救治有效性,臨床專家撰寫多個專家共識,國家出臺相應指導原則和法規,對ECMO技術的使用規范起到指導作用。
●《成人體外膜氧合循環輔助專家共識》2018版
●《新生兒呼吸衰竭體外膜肺氧合支持專家共識》
●《成人體外膜肺氧合患者院際轉運專家共識》
●《不同情況下成人體外膜肺氧合臨床應用專家共識》2020版
●《新型冠狀病毒肺炎體外膜肺氧合支持治療專家共識》
●《國家限制類技術臨床應用管理規范》2022年版
●《國家藥監局體外膜氧合(ECMO)循環套包-注冊審查指導原則》
●《新型冠狀病毒感染診療方案(試行第十版)》
熱點賽道,蓄勢待發
國產技術的崛起令人欣喜,相較發達國家,我國ECMO市場潛力巨大,臨床、科研、政策、資本等多方關注也證實了ECMO賽道的火熱,期待國產化進程的加速落地,為臨床危重癥患者帶來更多診療選擇,我們也將持續關注醫療行業前沿動向。
- END -
公眾號 : 奧泰康
微信號:Aotaikang2006
添加微信可獲取文中源文件
【關于我們】
奧泰康成立于2006年,為生物醫藥行業提供CRO&CDMO一體化服務。公司致力成為醫藥行業MA解決方案領導者,為健康事業持續創造新的價值。集團通過提供時效性強、成本可控、質量有保障和專業性的研究開發、產品檢測、動物實驗、臨床試驗和產品注冊全程解決方案,持續推動安全、有效和質量可控的產品進入市場,保障人類生命健康。
地址:北京市豐臺區南四環西路186號漢威國際廣場二區2號樓7層
電話:400-080-9519;010-83739181
郵箱:services@healtech.com.cn
網址:http://m.fairfaxmanagement.com